


“仿制药质量一致性评价”主要针对2007年新版《药品注册管理办法》颁布实施之前批准的化学药品仿制药口服固体制剂进行质量再评价,主要包括片剂、胶囊剂和颗粒剂等,评价主要考察药学质量一致性和疗效一致性。药学质量评价主要考察国产仿制制剂与参比制剂在溶出度和有关物质等关键质量指标上是否一致。如果质量不一致,则企业需要对产品处方工艺进行二次开发。
 服务内容
服务内容仿制药一致性评价流程
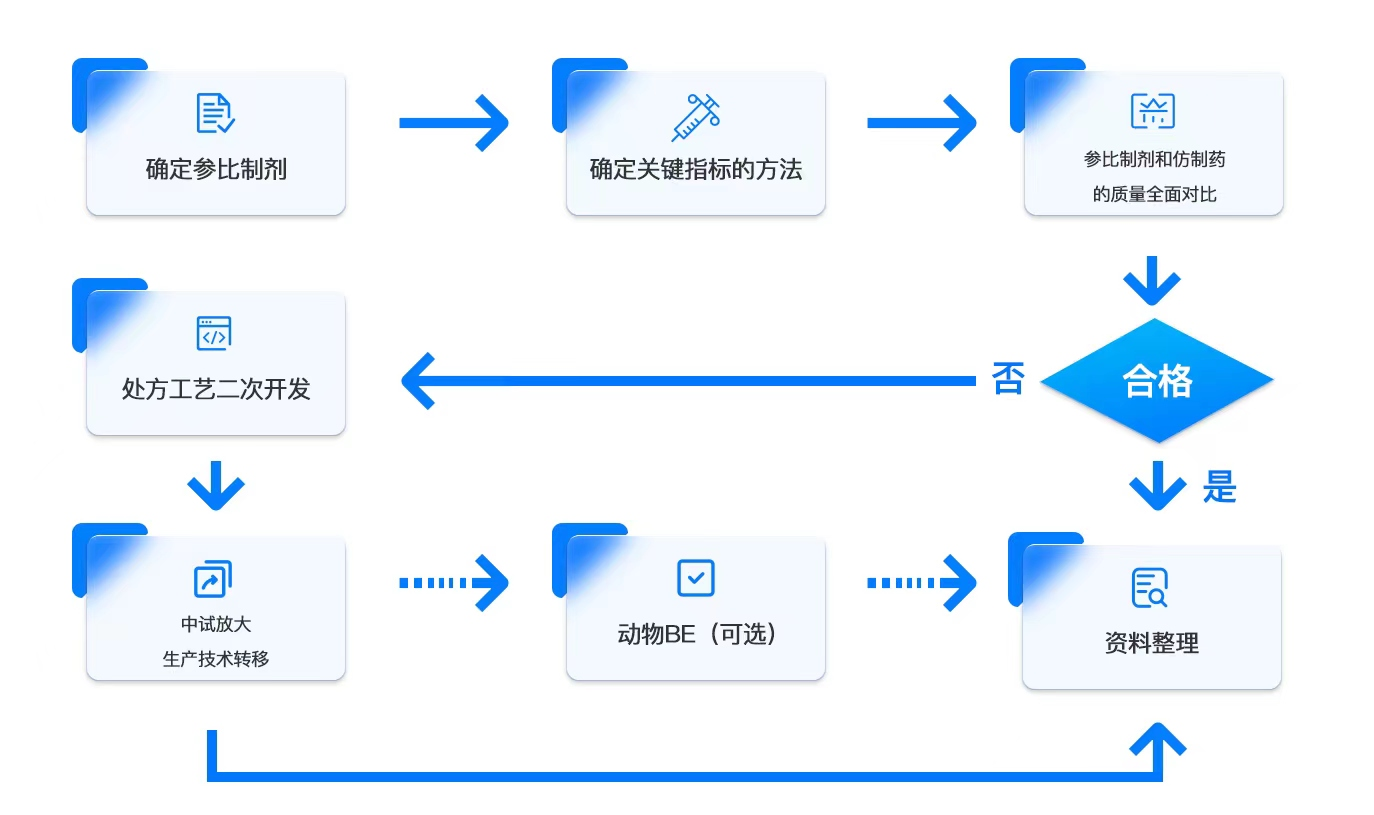
参比制剂和仿制药的质量全面比对
确定溶出曲线的测定条件,测定溶出曲线,进行溶出曲线的比对;
确定有关物质、异构体等分析方法;
测定有关物质、含量、异构体等;
原料药的晶型研究;
稳定性研究。
处方工艺二次开发服务
更深入地原研制剂的质量研究;
原料药性质研究;
调整优化处方和工艺并逐级放大,确保处方工艺的耐用性;
中试放大/生产技术转移;
质量研究。
动物BE服务
通过临床研究合作伙伴完成BE服务,为制剂的优化提供数据支持,降低临床BE风险
报告模板和SOPs
完成约定的分析条款;
提供准确且合规的文件;
提供可追溯性完整性等高质量的符合NMPA的要求原始数据。
 服务特点
服务特点诺和晟泰具有仿制药研发丰富的经验,能为您提供更专业的一致性评价服务。
专业的工作背景,已成功申报了多个仿制药品种;
完整的质量保证体系,保证数据的准确性、真实、可追溯和完整性;
规范的操作标准,完善的方案和报告模板,高效的工作流程;
先进、完善的硬件支持,保证项目的效率和完成时间;
拥有紧密的研究合作伙伴,为进度全方位保驾护航。
 相关实验室
相关实验室




 相关文章
相关文章